武汉物数所唐淳研究员带领的生物大分子动态学研究团队,于6月13日在Proceedings of the National Academy of Sciences(PNAS)在线发表题为“Ubiquitin S65 phosphorylation engenders a pH-sensitive conformational switch”的研究论文。他们的工作揭示了泛素单体的S65被磷酸化后,呈现出四种能相互转化的构象,解析了每种构象的三维结构,发现了这些构象的组成比例受pH值调节。进一步,利用单分子荧光技术,他们发现泛素单体的构象变化还影响到泛素链的四级结构,导致泛素能够与不同的靶蛋白结合,执行不同的功能。
2014年的研究报道首次指出泛素能被PINK1在其S65位点磷酸化,磷酸化泛素能激活PARKIN,导致线粒体自噬,但对于磷酸化泛素其它的生物学功能仍不清楚。在最新的这篇PNAS论文中,武汉物数所生物大分子动态学研究团队运用生物磁共振技术和其它生物物理方法,对磷酸化泛素同时存在的舒展态和收缩态结构进行了精确的解析,发现舒展态和收缩态磷酸化泛素的磷酸基团有着截然不同的pKa值,分别为7.2和5.8。因此当溶液pH升高时,磷酸化泛素会趋于收缩态结构,而当溶液pH降低,磷酸化泛素会趋于舒展态结构。
在细胞中,不同亚细胞部位有不同的pH值,细胞在不同的生理和病理状态下,局域的pH值也发生变化。磷酸化和泛素化是两种最为常见的蛋白质翻译后修饰,磷酸化能够赋予泛素的结构和功能对环境pH的敏感性,这一发现将对生物学研究产生深远影响。
唐淳研究员带领的生物大分子动态学研究团队多年从事泛素动态结构的研究,已作出了一系列的重要发现。他们利用波谱分析,首次发现泛素单体之间存在极弱的非共价作用(Angew. Chem., 2012),这种非共价相互作用,可以调节泛素链亚基之间的四级结构,使泛素链通过构象选择机制与结构和功能各异的配体发生相互作用(eLife, 2015)。
生物大分子动态学研究团队的董旭副研究员和龚洲副研究员为本文共同第一作者。毕业于武汉物数所生物大分子动态学研究组的刘主博士,现就职于浙江大学医学院,为本文的共通讯作者参与相关研究成果的发表。这项研究得到了科技部、国家自然科学基金委和美国霍华德休斯医学研究所(HHMI)基金资助。
附:论文链接
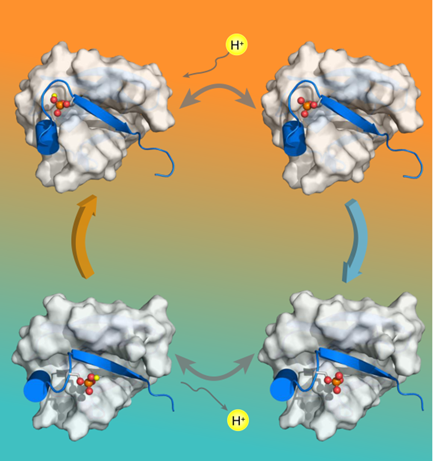
溶液中磷酸化泛素的多态平衡图示。随着pH升高(由橙色背景至青色背景表示)磷酸化泛素被去质子化,会趋于收缩态结构;随着pH减低(由青色背景至橙色背景表示)磷酸化泛素被质子化,会趋于舒展态结构。